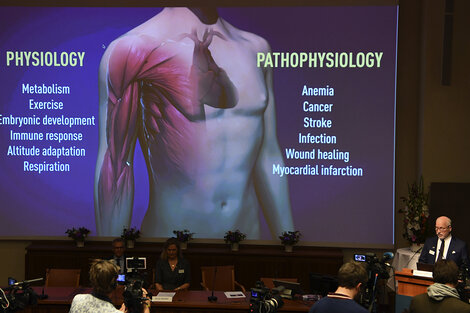
William Kaelin, Peter Ratcliffe y Gregg Semenza obtuvieron el Nobel de Medicina o Fisiología gracias a sus descubrimientos vinculados a cómo “las células se adaptan al oxígeno disponible”. Identificaron, en este sentido, “de qué manera opera la maquinaria molecular que regula la actividad de los genes responsables”, según anunció desde Estocolmo el comité organizador. La exploración de este proceso podría ser fundamental para el estudio de problemas de salud variopintos como anemia, diabetes, enfermedades cardiovasculares y cáncer. El 10 de diciembre se realizará la ceremonia y los galardonados se repartirán los nueve millones de coronas suecas, cifra que roza el millón de dólares.
“Las células modifican su expresión génica ante concentraciones bajas de oxígeno (hipoxia). Los tres investigadores premiados permitieron entender cómo está regulado ese mecanismo celular”, señala Pablo Wappner, Investigador del Conicet y jefe del Laboratorio de Genética y Fisiología Molecular de la Fundación Instituto Leloir (FIL). Todas las formas complejas de vida utilizan oxígeno para la respiración celular. Los humanos hemos naturalizado a tal punto su presencia que, si bien sabemos que es vital para sobrevivir, usualmente, no cuestionamos su falta. Salvo por estos tres referentes. Kaelin y Semenza nacieron en Nueva York y realizan sus aportes desde EEUU, aunque el primero imparte clases en Harvard y el otro en la Universidad Johns Hopkins. Por su parte, Ratcliffe es británico y realiza sus contribuciones desde la Universidad de Oxford.
Los hallazgos por los que recibieron el Nobel
Comencemos por el principio. Los genes regulan su expresión a partir de proteínas que funcionan como “factores de transcripción”. Desde aquí, el factor “maestro”, el padre de todos los factores, el más importante de todos y que regula miles de genes en la actividad de respiración celular se denomina HIF (hipoxia inducible factor, por sus siglas en inglés). Fue descubierto, a través de diferentes estrategias, por Ratcliffe y Semenza a mediados de los 80’s y, años más tarde (2001), como si fuera poco, también hallaron la molécula –sensora– que detecta las concentraciones de oxígeno; una enzima que específicamente modifica a HIF. Kaelin, asimismo, se concentró en analizar aquellas variables claves para comprender la actividad de la proteína.
Ahora bien, ¿de qué manera funciona HIF? “Por destrucción, una degradación permanente. Cuando hay oxígeno está constantemente siendo destruida, mientras que en hipoxia deja de destruirse y se acumula rápidamente. Aquí, justamente, sobreviene la capacidad de adaptación celular”, plantea Wappner. “Lo interesante es que cada célula, en distintos órganos y tejidos, está adaptada a una condición de oxígeno particular. Por ejemplo, en el timo hay mucho menos que en el pulmón mientras que en el hígado hay mucho más que en el riñón. Existe un mecanismo celular que les ‘enseña’ a detectar los niveles de oxígeno”, apunta Diego Croci, Investigador del Conicet en el Instituto de Histología y Embriología de Mendoza. Y completa: “HIF es la vedette, ya que es el factor que monitorea la cantidad de oxígeno en las células. Es una proteína que se expresa todo el tiempo y se degrada, con lo cual, aunque energéticamente es un proceso caro para la maquinaria celular, se trata de la forma más veloz para responder cuando no haya oxígeno”.
A partir del hallazgo de HIF, las farmacéuticas pararon las antenas y advirtieron la importancia del asunto. Bajo esta premisa, ¿cuál es la relación entre la respiración celular y enfermedades como el cáncer? “Tiene un impacto enorme en cuestiones de salud. Dentro de un tumor que crece hay poco oxígeno porque no recibe la suficiente irrigación sanguínea. Por ello, si el tumor quiere prevalecer se debe adaptar a hipoxia. Bloquear esta estrategia es una forma de poner una barrera al avance de la enfermedad”, describe Wappner. De manera opuesta, “cuando al corazón le falta el oxígeno que recibe de manera permanente sufre hipoxia y, eventualmente, se produce un infarto. Si ese corazón se adapta de manera adecuada a la hipoxia, las consecuencias podrían evitarse”, subraya. Los accidentes cerebrovasculares (ACV) también ocurren por la falta de irrigación sanguínea en alguna región cerebral; de modo que si el sector comprometido pudiera acomodarse frente a la escasez de oxígeno se mitigarían los efectos del problema.
Aunque hoy en día Croci trabaja en Mendoza, forma parte del equipo de Gabriel Rabinovich en Buenos Aires. “En 2012 publicamos un trabajo en el que vimos que Galectina-1 se encontraba regulada por la hipoxia. Cuando las células tumorales detectan la falta de oxígeno producen esta proteína e incrementan su expresión”. Por ello, en la actualidad, procura “entender de qué manera la hipoxia afecta el funcionamiento normal del sistema inmunológico. Cuando un linfocito (glóbulo blanco) llega al tumor se encuentra con un escenario trastocado y afecta su biología” narra.
Como dato anecdótico y singular, vale destacar que Ratcliffe y Wappner son amigos desde jóvenes. “Él era una persona muy poco conocida y comenzábamos a abordar estos temas cuando tan solo se ocupaban 20 expertos en el mundo. Evidentemente, a él le fue mejor que a mí”, lanza con tono jocoso. “Colaboramos desde hace más de dos décadas en papers, congresos y subsidios compartidos. Nos llevamos tan bien que entablamos una buena amistad. Fue muy lindo verlo crecer, fui un testigo privilegiado de la trayectoria inmensa del hoy Premio Nobel de Medicina”, lanza el referente del Instituto Leloir, institución que recibió la visita de Ratcliffe en junio pasado.
Desde 1901 hasta la fecha se habían entregado 109 premios en la categoría, aunque 216 personas resultaron laureadas, ya que los galardones pueden ser compartidos. Del total, tan solo 12 mujeres fueron reconocidas. Esta vez no fue la excepción y, nuevamente, tres hombres fueron distinguidos. El fixture sigue así: mañana (martes) se premiarán los aportes en Física; pasado en Química, el jueves Literatura y el viernes estará reservado para el de la Paz. El próximo lunes, finalmente, será el turno de Economía.
![function body_3(chk,ctx){return chk.f(ctx.getPath(false, ["author","title"]),ctx,"h");}](https://images.pagina12.com.ar/styles/width470/public/2020-07/pablo-esteban.png?itok=_-8eLPCE)